As questões de Termoquímica no Enem envolvem a relação entre a quantidade de calor das reações com assuntos como combustão, combustíveis, alimentação e fotossíntese.
Hoje iremos dar dicas de termoquímica para o Enem. Esse conteúdo já foi cobrado em anos anteriores e pode ser exigido novamente porque ele está relacionado com aspectos importantes do meio ambiente, como a fotossíntese; bem como com a tecnologia e a sociedade, como alimentação,calorias, carboidratos e reações de combustão.
A termoquímica é o ramo que estuda a quantidade de calor liberada ou absorvida nas reações químicas e em determinados fenômenos físicos (mudanças de estado físico). Assim, as questões de termoquímica no Enem costumam relacionar a quantidade de calor com os fenômenos citados.
Para se sair bem no Enem nesse conteúdo, é necessário que o candidato preste atenção em alguns aspectos importantes, dentre eles, podemos destacar:
* Diferenciar reações ou processos endotérmicos e exotérmicos: O processo endotérmico é o que absorve calor e o exotérmico libera calor;
* Saber o que é entalpia (H), variação de entalpia (∆H), entalpia-padrão (H0) e variação de entalpia padrão (∆H0);
* Saber escrever e interpretar equações termoquímicas. É importante lembrar que, nas equações termoquímicas, aparece o valor da variação de entalpia (∆H), isto é, do calor envolvido nessas reações ou processos físicos; e que, se o valor de ∆H é negativo, a reação é exotérmica, mas se é positivo, a reação é endotérmica.
* Lembrar-se da Lei de Hess, que, resumidamente, diz que o valor de ∆H depende somente dos estados inicial e final da reação, além de ser sempre o mesmo, independente do caminho pelo qual ela é realizada (direta ou por meio de várias etapas).
* Saber o que é entalpia (H), variação de entalpia (∆H), entalpia-padrão (H0) e variação de entalpia padrão (∆H0);
* Saber escrever e interpretar equações termoquímicas. É importante lembrar que, nas equações termoquímicas, aparece o valor da variação de entalpia (∆H), isto é, do calor envolvido nessas reações ou processos físicos; e que, se o valor de ∆H é negativo, a reação é exotérmica, mas se é positivo, a reação é endotérmica.
* Lembrar-se da Lei de Hess, que, resumidamente, diz que o valor de ∆H depende somente dos estados inicial e final da reação, além de ser sempre o mesmo, independente do caminho pelo qual ela é realizada (direta ou por meio de várias etapas).
Detalhes sobre esses e outros assuntos estudados em termoquímica podem ser vistos nos textos listados na seção abaixo:
Agora, vamos ver alguns exemplos de questões de termoquímica que caíram no Enem em provas passadas e como proceder para resolvê-las:
Exemplo 1: Enem 2009 – caderno azul:

Questão 43 do Enem – 2009 sobre termoquímica
Resolução:
Observe que essa questão engloba também os conteúdos de reações de combustão e combustíveis. Desse modo, é importante você saber escrever as equações químicas que representam esse tipo de reação e relacionar os coeficientes estequiométricos com o que foi pedido. O texto Entalpia de Combustão ensina que a variação de entalpia-padrão é determinada somente para reações de combustão completas (não para incompletas), e o artigo Combustão Completa e Incompleta ensina que toda combustão completa de compostos orgânicos, como os combustíveis listados nessa questão, tem a sua equação escrita da seguinte forma:
Combustível + O2 → CO2 + H2O
Assim, para resolver essa questão, basta escrever as equações de combustão completa de cada combustível (metano (gás natural), butano (GLP) e octano (gasolina)) e relacionar os coeficientes da equação com o valor da variação de entalpia-padrão (∆H0). É claro que não podemos nos esquecer de realizar o balanceamento das equações. Veja:
I. Metano (gás natural):
1 CH4+ 2 O2 → 1 CO2 + 2 H2O
1 mol de CH4 produz 1 mol de CO2, liberando 890 kJ (segundo dado fornecido na tabela).
II. Butano (GLP):
1 C4H10+ 13/2 O2 → 4 CO2 + 5 H2O
1 mol de C4H10 produz 4 mol de CO2, liberando 2.878 kJ (segundo dado fornecido na tabela). Mas queremos saber o calor fornecido para 1 mol de CO2. Então:
4 mol ---- 2.878 kJ
1 mol ---- x
x = 719,5 kJ
4 mol ---- 2.878 kJ
1 mol ---- x
x = 719,5 kJ
III. Octano (gasolina):
1 C8H18+ 25/2 O2 → 8 CO2 + 9 H2O
1 mol de C8H18 produz 8 mol de CO2, liberando 5.471 kJ (segundo dado fornecido na tabela). Mas queremos saber o calor fornecido para 1 mol de CO2. Então:
8 mol ---- 5.471 kJ
1 mol ---- y
y = 683,9 kJ
8 mol ---- 5.471 kJ
1 mol ---- y
y = 683,9 kJ
Desse modo, temos que, do ponto de vista da quantidade de calor obtida por mol de CO2 gerado, a ordem crescente desses três combustíveis é: gasolina, GLP e gás natural. A alternativa correta é a letra “A”.
Exemplo 2: Enem 2010 – caderno azul:
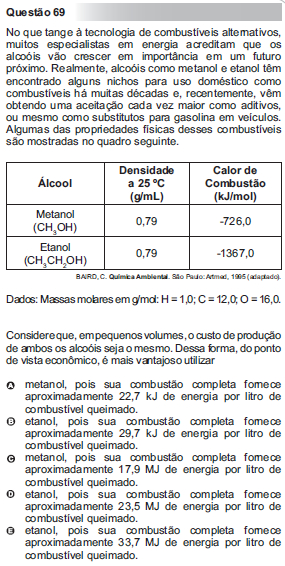
Questão 69 do Enem – 2010 sobre termoquímica
Resolução:
Nas alternativas, mencionam-se os conteúdos de energia por litro, assim, precisamos transformar a densidade dos combustíveis de g/mL para g/L:
dmetanol = 0,79 g/mL = 790 g/L;
detanol = 0,79 g/mL = 790 g/L
detanol = 0,79 g/mL = 790 g/L
As massas moleculares do metanol e do etanol são dadas por:
Mmetanol = 32 g/mol;
Metanol = 46 g/mol.
Metanol = 46 g/mol.
Se você tem alguma dúvida sobre como encontrar as massas moleculares das substâncias, leia o artigo: Massa molecular.
Agora nós relacionamos a quantidade em massa com a quantidade em mol:
1 mol ------ 32 g 1 mol ------ 46 g
nmetanol ------ 790 g netanol ------ 790 g
nmetanol = 24,6875 mol netanol = 17,1739 mol
nmetanol ------ 790 g netanol ------ 790 g
nmetanol = 24,6875 mol netanol = 17,1739 mol
Enfim, podemos calcular a quantidade de energia em “mol”:
Metanol: Etanol:
1 mol ------------- 726 kJ 1 mol ------------- 1367 kJ
24,6875 mol --- x 17,1739 mol ---- y
x = 17923,125 kJ ou 17,9 MJ y = 23476,7213 kJ ou 23,5 MJ
1 mol ------------- 726 kJ 1 mol ------------- 1367 kJ
24,6875 mol --- x 17,1739 mol ---- y
x = 17923,125 kJ ou 17,9 MJ y = 23476,7213 kJ ou 23,5 MJ
A alternativa correta é a letra “d”.
Exemplo 3: Enem 2011 – caderno azul:

Questão 50 do Enem – 2011 sobre termoquímica
Resolução:
Do mesmo modo que no exemplo 1, vamos escrever as equações de combustão completa para cada combustível devidamente balanceadas e relacionar a quantidade de energia liberada com a quantidade de mols de CO2 produzida. Como essa questão quer saber para a mesma quantidade de energia produzida, iremos estabelecer um valor de 1000 kJ:
1. Benzeno: 1 C6H6 + 15/2 O2 → 6 CO2 + 3 H2O
6 mol de CO2 ------ 3268 kJ
nCO2 ------------ 1000 kJ
nCO2 = 1,83 mol de CO2
6 mol de CO2 ------ 3268 kJ
nCO2 ------------ 1000 kJ
nCO2 = 1,83 mol de CO2
2. Etanol: 1 C2H5OH + 3 O2 → 2 CO2 + 3 H2O
2 mol de CO2 ------ 1368 kJ
nCO2 ------------ 1000 kJ
nCO2 = 1,46 mol de CO2
2 mol de CO2 ------ 1368 kJ
nCO2 ------------ 1000 kJ
nCO2 = 1,46 mol de CO2
3. Glicose: 1 C6H12O6 + 6 O2 → 6 CO2 + 6 H2O
6 mol de CO2 ------ 2808 kJ
nCO2 ------------ 1000 kJ
nCO2 = 2,13 mol de CO2
6 mol de CO2 ------ 2808 kJ
nCO2 ------------ 1000 kJ
nCO2 = 2,13 mol de CO2
4. Metano: 1 CH4+ 2 O2 → 1 CO2 + 2 H2O
1 mol de CO2 ------ 890 kJ
nCO2 ------------ 1000 kJ
nCO2 = 1,12 mol de CO2
1 mol de CO2 ------ 890 kJ
nCO2 ------------ 1000 kJ
nCO2 = 1,12 mol de CO2
5. Octano: 1 C8H18+ 25/2 O2 → 8 CO2 + 9 H2O
8 mol de CO2 ------ 5471 kJ
nCO2 ------------ 1000 kJ
nCO2 = 1,46 mol de CO2
8 mol de CO2 ------ 5471 kJ
nCO2 ------------ 1000 kJ
nCO2 = 1,46 mol de CO2
Observe que o combustível que libera a maior quantidade de CO2 para a mesma quantidade de energia é a glicose. A alternativa correta é a letra “c”.


.gif)






0 comentários:
Postar um comentário