O Modelo de Repulsão dos Pares Eletrônicos da Camada de Valência (RPECV) é empregado para explicar a estrutura molecular, ou seja, a forma como os átomo se organizam espacialmente em uma molécula.
Para explicar a estrutura molecular é bastante simples, basta seguir os seguintes passos:
i.
Escrever a estrutura de Lewis da
molécula e encontrar o total de elétrons de valência do átomo
central;
ii.
Orientar os pares de
elétrons de VALÊNCIA do átomo central de modo que seja máxima a distância (ou
os ângulos) entre eles. O que permite estabilizar a molécula diminuindo a
repulsão entre esses pares de elétrons.
a) Geometria Linear
i. Estrutura de Lewis do BeCl2:
ii. Modelo RPECV:
a.2) Molécula de CO2 (total de
elétrons de valência: 4 + 2 x 6 = 16)
i. Estrutura de Lewis:
ii. Método RPECV:
b) Geometria tetraédrica
b.1) Molécula de CH4 (Total de
elétrons de valência: 4 + 4 x 1 = 8)
i. Estrutura de Lewis:
ii. Modelo RPECV
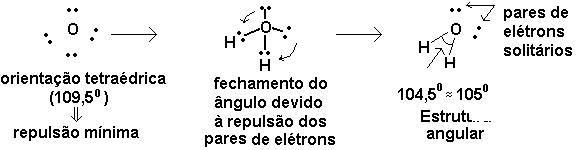
c) Geometria angular
c.1) Molécula de H2O (total de
elétrons de valência: 2 x 1 + 6 = 8)
i. Estrutura de Lewis:
ii. Modelo RPECV:
c.2) Molécula de SO2 (total de
elétrons de valência: 6 + 3 x 6 = 18)
i. Estrutura de Lewis:
ii. Modelo RPECV:
d) Geometria Piramidal
d.1) Molécula de NH3 (total de
elétrons de valência: 5 + 3 x 1=8)
i. Estrutura de Lewis:
ii. Modelo RPECV:
e) Bipirâmide trigonal
e.1) Molécula de PCl5 (40 elétrons
de valência)
i. Estrutura de Lewis:
ii. Modelo RPECV:
f) Geometria octaédrica
f.1) Molécula de SF6 (48 elétrons
de valência)
i. Estrutura de Lewis:
ii. Modelo RPECV:
g) Geometria Piramidal Tetragonal
g.1) Molécula de IF5 (total de 42
elétrons de valência)
i. Estrutura de Lewis:
ii. Modelo RPECV
h) Quadrado planar
h.1) Íon-molécula de ICl4- (36
elétrons de valência)
i. Estrutura de Lewis:
i.
Modelo RPECV
Pares
de elétrons de ligação
|
Pares
solitários
|
Forma
|
Ângulo
de ligação ideal (ângulo exemplo de ligação)
|
Exemplo
|
Imagem
|
2
|
0
|
linear
|
180 °
|
||
3
|
0
|
planar trigonal
|
120 °
|
||
2
|
1
|
Angular
|
120 °
(119 °)
|
||
4
|
0
|
tetraédrica
|
109,5 °
|
||
3
|
1
|
piramidal trigonal
|
107 °
|
||
2
|
2
|
Angular
|
109,5 °
(104,5 °)
|
||
5
|
0
|
bipiramidal trigonal
|
90 °,
120 °, 180 °
|
||
4
|
1
|
Tetraédrica irregular
|
180 °,
120 °, 90 ° (173,1 °, 101,6 °)
|
||
3
|
2
|
Em forma de T
|
90 °,
180 ° (87,5 ° C, <180 °)
|
||
2
|
3
|
linear
|
180 °
|
||
6
|
0
|
octaédrico
|
90 °,
180 °
|
||
5
|
1
|
quadrado piramidal
|
90 °
(84,8 ° C), 180 °
|
||
4
|
2
|
quadrado planar
|
90 °,
180 °
|
||
7
|
0
|
pentagonal bipiramidal
|
90 °,
72 °, 180 °
|


.gif)







































0 comentários:
Postar um comentário